1. Biografi
Amedeo Avogadro menjalani kehidupan yang kaya, dari latar belakang bangsawan hingga keterlibatannya dalam pendidikan, penelitian ilmiah, dan pelayanan publik, meskipun ia menghadapi tantangan politik.
1.1. Kelahiran dan Kehidupan Awal
Lorenzo Romano Amedeo Carlo Avogadro lahir di Torino, Kerajaan Sardinia (kini bagian dari Italia), pada tanggal 9 Agustus 1776. Ia berasal dari keluarga bangsawan terkemuka di Piedmont. Ayahnya, Filippo Avogadro, adalah seorang pengacara dan bangsawan yang memegang posisi penting di Kerajaan Sardinia, sementara ibunya bernama Anna Vercellone.
1.2. Pendidikan
Avogadro menyelesaikan pendidikan formalnya di bidang hukum gerejawi pada usia 20 tahun, meraih gelar doktor pada tahun 1796. Setelah itu, ia mulai berpraktik sebagai pengacara. Namun, ketertarikannya yang mendalam pada ilmu pengetahuan mendorongnya untuk secara mandiri mempelajari fisika dan matematika, yang pada masa itu dikenal sebagai "filsafat positif".
1.3. Karier Awal dan Aktivitas Akademis
Setelah beberapa tahun berpraktik hukum, Avogadro mulai menunjukkan minatnya pada matematika dan fisika sekitar tahun 1800. Pada tahun 1803, ia menyerahkan makalah pertamanya mengenai teknik listrik kepada Akademi Sains Turin. Pada tahun 1806, ia menjadi asisten profesor di Universitas Turin, dan pada tahun 1809, ia mulai mengajar fisika dan matematika di sebuah liceo (sekolah menengah) di Vercelli, tempat keluarganya tinggal dan memiliki properti.
Pada tahun 1811, ia menerbitkan artikel penting berjudul Essai d'une manière de déterminer les masses relatives des molécules élémentaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons (Esai tentang Cara Menentukan Massa Relatif Molekul Elementer Benda, dan Proporsi Kombinasinya). Artikel ini, yang berisi hipotesis Avogadro, diserahkan kepada Journal de Physique, de Chimie et d'Histoire naturelle (Jurnal Fisika, Kimia, dan Sejarah Alam) milik Jean-Claude Delamétherie, dan ditulis dalam bahasa Prancis.
1.4. Kegiatan Profesor
Pada tahun 1820, Avogadro diangkat sebagai profesor fisika di Universitas Turin, yang saat itu menjadi ibu kota Kerajaan Sardinia yang telah dipulihkan di bawah Raja Victor Emmanuel I dari Sardinia.
Avogadro aktif dalam gerakan revolusi Maret 1821 yang menentang Raja Victor Emmanuel I. Akibat keterlibatannya ini, ia kehilangan jabatannya pada tahun 1823. Secara resmi, universitas menyatakan bahwa ia "sangat senang mengizinkan ilmuwan menarik ini untuk beristirahat dari tugas mengajar yang berat, agar dapat memberikan perhatian yang lebih baik pada penelitiannya." Namun, ia dipanggil kembali ke Universitas Turin pada tahun 1833, di mana ia mengajar selama dua puluh tahun lagi hingga tahun 1850.
1.5. Kegiatan Politik dan Pelayanan Publik
Selain karier akademisnya, Avogadro juga terlibat dalam politik dan pelayanan publik. Ia aktif dalam gerakan revolusioner di Piedmont pada Maret 1821. Meskipun ia kehilangan jabatannya di universitas karena alasan politik, Raja Charles Albert dari Savoy akhirnya memberikan konstitusi yang dikenal sebagai Statuto Albertino pada tahun 1848, yang mencerminkan semangat perubahan yang diperjuangkan Avogadro.
Avogadro juga memegang berbagai jabatan publik yang berkaitan dengan statistik, meteorologi, serta bobot dan ukuran. Ia berperan penting dalam memperkenalkan sistem metrik ke wilayah Piedmont. Selain itu, ia adalah anggota Dewan Tinggi Kerajaan untuk Instruksi Publik, menunjukkan komitmennya terhadap pendidikan dan administrasi negara.
1.6. Kehidupan Pribadi
Sedikit yang diketahui tentang kehidupan pribadi Avogadro, yang digambarkan sebagai sosok yang tenang dan religius. Ia menikah dengan Felicita Mazzé dan dikaruniai enam orang anak. Beberapa sejarawan menyebutkan bahwa ia juga mensponsori beberapa revolusioner Sardinia.
1.7. Kematian
Amedeo Avogadro meninggal dunia di Torino pada tanggal 9 Juli 1856, pada usia 80 tahun.
2. Pencapaian Ilmiah
Kontribusi ilmiah Avogadro sangat fundamental bagi perkembangan kimia dan fisika modern, terutama melalui hukum yang dinamai menurut namanya dan pembedaan krusial antara atom dan molekul.
2.1. Hukum Avogadro
Hukum Avogadro adalah salah satu kontribusi paling terkenal dari Amedeo Avogadro. Hukum ini menyatakan bahwa pada suhu dan tekanan yang sama, volume gas yang sama akan mengandung jumlah molekul yang sama. Ini berarti bahwa hubungan antara massa volume gas yang sama (pada suhu dan tekanan yang sama) sesuai dengan hubungan antara berat molekul masing-masing. Oleh karena itu, massa molekul relatif suatu gas dapat dihitung dari massa sampel dengan volume yang diketahui.
Avogadro mengembangkan hipotesis ini setelah Joseph Louis Gay-Lussac menerbitkan hukumnya tentang volume gas dan kombinasi gas pada tahun 1808. Hukum Avogadro menjadi dasar penting dalam perhitungan reaksi kimia dan memungkinkan para kimiawan untuk menentukan jumlah zat yang dihasilkan dalam reaksi tertentu dengan tingkat akurasi yang tinggi.
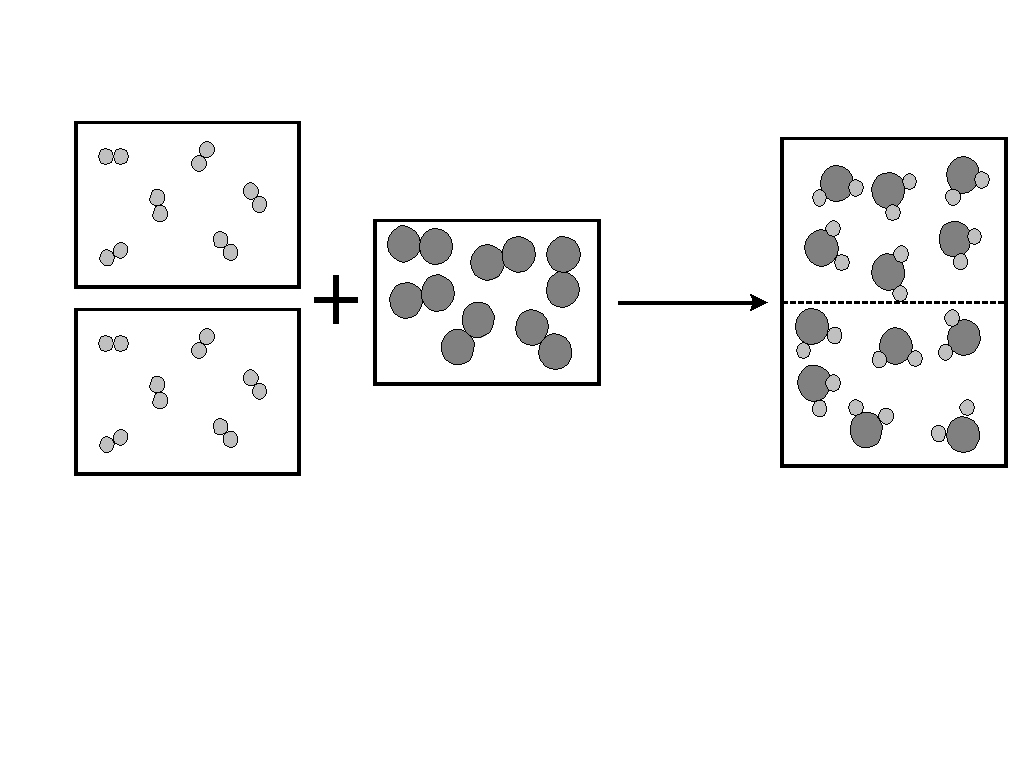
Sebagai contoh, jika dua volume hidrogen bereaksi dengan satu volume oksigen untuk menghasilkan dua volume uap air, hukum Avogadro menjelaskan bahwa ini terjadi karena hidrogen dan oksigen ada sebagai molekul diatomik (H2 dan O2), bukan atom tunggal. Reaksi ini dapat ditulis sebagai:
Ini secara langsung menjelaskan rasio volume 2:1:2 yang diamati dalam eksperimen.
2.2. Perbedaan Atom dan Molekul
Salah satu kontribusi Avogadro yang paling krusial adalah kemampuannya untuk dengan jelas membedakan antara atom dan molekul, sebuah konsep yang sangat membingungkan pada masanya. Ia menyatakan bahwa gas terdiri dari molekul, dan molekul-molekul ini pada gilirannya tersusun dari atom. Ini adalah pemikiran yang revolusioner, karena ilmuwan seperti John Dalton pada awalnya tidak mempertimbangkan kemungkinan bahwa unsur-unsur gas dapat ada dalam bentuk molekul yang terdiri dari dua atau lebih atom yang sama.
Meskipun Avogadro sendiri tidak secara eksplisit menggunakan kata "atom" (karena istilah "atom" dan "molekul" sering digunakan secara bergantian), ia mengemukakan adanya tiga jenis "molekul", salah satunya adalah "molekul elementer" yang kita kenal sekarang sebagai atom. Selain itu, ia juga memberikan perhatian lebih pada definisi massa, membedakannya dari berat, yang merupakan langkah penting dalam pengembangan pemahaman konsep-konsep dasar kimia dan fisika.
2.3. Konstanta Avogadro
Sebagai penghormatan atas kontribusi Avogadro pada teori molekuler, rasio jumlah entitas dasar (seperti atom, molekul, ion, atau partikel lainnya) dalam suatu zat terhadap jumlah zatnya (yang diukur dalam satuan mol) dinamakan Konstanta Avogadro, dilambangkan dengan NA. Nilai konstanta Avogadro adalah sekitar 6,02214076 × 1023 per mol, dan merupakan salah satu dari tujuh konstanta dasar SI yang mendefinisikan sistem satuan internasional.
Konstanta ini sangat penting dalam kimia dan fisika karena memungkinkan para kimiawan untuk menghitung hasil reaksi kimia dan menentukan jumlah zat yang dihasilkan dengan akurasi tinggi. Nilai konstanta Avogadro pertama kali dihitung oleh Johann Josef Loschmidt, yang kadang-kadang disebut sebagai Bilangan Loschmidt di negara-negara berbahasa Jerman, meskipun "konstanta Loschmidt" kini memiliki makna yang berbeda.
2.4. Tulisan Utama
Selain artikelnya yang terkenal pada tahun 1811, Avogadro juga menghasilkan sejumlah publikasi penting lainnya sepanjang kariernya:
- Pada tahun 1815, ia menerbitkan Mémoire sur les masses relatives des molécules des corps simples, ou densités présumées de leur gaz, et sur la constitution de quelques-uns de leur composés, pour servir de suite à l'Essai sur le même sujet, publié dans le Journal de Physique, juillet 1811 (Catatan tentang Massa Relatif Molekul Elementer, atau Densitas Gas yang Disarankan, dan Konstituen Beberapa Senyawanya, Sebagai Tindak Lanjut dari Esai tentang Subjek yang Sama, Diterbitkan dalam Jurnal Fisika, Juli 1811), yang membahas tentang densitas gas.
- Pada tahun 1821, ia menerbitkan makalah lain berjudul Nouvelles considérations sur la théorie des proportions déterminées dans les combinaisons, et sur la détermination des masses des molécules des corps (Pertimbangan Baru tentang Teori Proporsi yang Ditentukan dalam Kombinasi, dan Penentuan Massa Atom).
- Tak lama setelah itu, ia juga merilis Mémoire sur la manière de ramener les composès organiques aux lois ordinaires des proportions déterminées (Catatan tentang Cara Menemukan Komposisi Organik berdasarkan Hukum Proporsi yang Ditentukan).
- Karya besarnya, Fisica dei corpi ponderabili, ossia Trattato della costituzione materiale de' corpi (Fisika Benda-benda yang Dapat Ditimbang, atau Risalah tentang Konstitusi Material Benda), diterbitkan dalam empat volume antara tahun 1837 dan 1841.
2.5. Bidang Penelitian Lainnya
Selain kontribusinya yang monumental terhadap teori molekuler, Avogadro juga melakukan penelitian ekstensif di berbagai bidang lain dalam fisika dan kimia. Ia menulis banyak makalah tentang listrik, distilasi cairan, kalor jenis, aksi kapiler, dan volume atom. Ia bahkan menerapkan hukumnya pada logam dan berhasil menghitung berat atom untuk 17 jenis logam yang berbeda, menunjukkan luasnya pemikiran ilmiahnya.
3. Respon terhadap Teori dan Evaluasi Ulang
Teori-teori Avogadro awalnya tidak diterima secara luas, namun kemudian mendapatkan pengakuan dan validasi yang krusial melalui karya-karya ilmuwan lain yang membuktikan relevansinya.
3.1. Penerimaan Awal dan Pengabaian
Teori-teori ilmiah Avogadro, khususnya hipotesisnya yang diterbitkan pada tahun 1811, awalnya tidak mendapatkan perhatian yang besar dari komunitas ilmiah dan tidak segera diterima secara luas. Bahkan, André-Marie Ampère mengajukan teori yang sangat mirip tiga tahun kemudian, pada tahun 1813, tetapi teorinya juga menghadapi sikap acuh tak acuh yang sama. Salah satu alasan mengapa karya Avogadro kurang diperhatikan pada masanya adalah karena gaya penulisannya yang dianggap sulit dipahami, kemungkinan karena latar belakangnya sebagai seorang pengacara.
3.2. Evaluasi Ulang dan Pengakuan
Pengakuan terhadap karya Avogadro baru datang bertahun-tahun setelah publikasinya. Melalui studi yang dilakukan oleh Charles Frédéric Gerhardt dan Auguste Laurent di bidang kimia organik, akhirnya dapat ditunjukkan bahwa Hukum Avogadro menjelaskan mengapa jumlah molekul yang sama dalam suatu gas memiliki volume yang sama.
Namun, eksperimen terkait dengan beberapa zat inorganik menunjukkan kontradiksi yang tampak terhadap hukum tersebut. Masalah ini akhirnya diselesaikan oleh Stanislao Cannizzaro, yang mengumumkan hasil penelitiannya pada Kongres Karlsruhe pada tahun 1860, empat tahun setelah kematian Avogadro. Cannizzaro menjelaskan bahwa pengecualian ini disebabkan oleh disosiasi molekuler pada suhu tertentu, dan bahwa Hukum Avogadro tidak hanya menentukan massa molekul tetapi juga massa atom.
Pada tahun 1911, sebuah pertemuan di Torino diselenggarakan untuk memperingati seratus tahun publikasi makalah klasik Avogadro tahun 1811. Raja Victor Emmanuel III dari Italia turut hadir, dan kontribusi besar Avogadro terhadap kimia akhirnya diakui secara luas. Selain itu, Rudolf Clausius dengan teori kinetik gas yang diusulkannya pada tahun 1857, memberikan bukti lebih lanjut untuk Hukum Avogadro. Jacobus Henricus van 't Hoff juga menunjukkan bahwa teori Avogadro berlaku dalam larutan encer.
4. Dampak dan Warisan
Warisan Avogadro sangat besar, membentuk dasar bagi pemahaman modern tentang materi dan diabadikan dalam berbagai penghargaan dan fenomena ilmiah.
4.1. Kontribusi terhadap Kemajuan Sains
Amedeo Avogadro diakui sebagai salah satu pendiri teori atom-molekul modern. Kontribusinya yang fundamental dalam membedakan antara atom dan molekul, serta hukumnya yang menghubungkan volume gas dengan jumlah molekul, meletakkan dasar bagi pemahaman kita tentang komposisi materi dan reaksi kimia. Karyanya yang visioner, meskipun awalnya diabaikan, terbukti menjadi pilar penting yang memungkinkan kemajuan signifikan dalam kimia dan fisika selama abad ke-19 dan seterusnya.
4.2. Peringatan dan Penghormatan
Sebagai bentuk penghormatan atas pencapaian ilmiahnya yang luar biasa, nama Avogadro diabadikan dalam beberapa konsep dan objek penting:
- Konstanta Avogadro (NA), seperti yang telah disebutkan, adalah salah satu konstanta fundamental dalam kimia dan fisika.
- Mineral Avogadrite, yang merupakan mineral kalium borat fluorida, dinamai untuk menghormatinya.
- Sebuah kawah di Bulan juga dinamai Kawah Avogadro.